СИСТЕМНЫЕ ОБРАЗОВАНИЯ: ИНФОРМАЦИЯ И ОТРАЖЕНИЕ
Вяткин В.Б.
СТРУКТУРНАЯ
ОРГАНИЗАЦИЯ ЭЛЕКТРОННЫХ СИСТЕМ
АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
В СВЕТЕ СИНЕРГЕТИЧЕСКОЙ ТЕОРИИ
ИНФОРМАЦИИ
// Ergo. Проблемы
методологии междисциплинарных
исследований и комплексного
обеспечения
научно-исследовательской
деятельности. Вып. 4. Екатеринбург:
УрО РАН, 2005
-------------------------------------------------------------------------------------------------------------------------
3.
Структурная организация
электронных систем
в плоскости электронных
подоболочек
В предыдущем
разделе рассматривалась
структурная организация
электронных систем атомов,
разделенных в плоскости
орбитального квантового числа на
совокупности s, p, d, f электронов,
выступавших в качестве системных
объектов. При этом распределение
электронов указанных
совокупностей по электронным
оболочкам атомов не учитывалось.
Сейчас объектом нашего анализа
будет являться структурная
организация электронных систем в
условиях, когда электроны s, p, d, f совокупностей
разделены в плоскости главного
квантового числа (n) на подгруппы,
образующие электронные
подоболочки ![]() . Иначе говоря,
электронные системы атомов
химических элементов будут
рассматриваться в виде систем
электронных подоболочек, а
последние, соответственно,
выступать в качестве системных
объектов. В данном случае,
обозначая количество электронов в
подоболочке (системном объекте)
через
. Иначе говоря,
электронные системы атомов
химических элементов будут
рассматриваться в виде систем
электронных подоболочек, а
последние, соответственно,
выступать в качестве системных
объектов. В данном случае,
обозначая количество электронов в
подоболочке (системном объекте)
через ![]() , R-функцию
структурной организации
электронной системы атома
химического элемента с порядковым
номером Z можно представить
в следующем виде:
, R-функцию
структурной организации
электронной системы атома
химического элемента с порядковым
номером Z можно представить
в следующем виде:
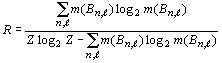 . ...........................................................................(26)
. ...........................................................................(26)
Снова беря в качестве примера электронную конфигурацию атома криптона:
![]() ,
,
расчет R-функции по формуле (26) демонстрируется следующим образом:
![]() .
.
С помощью формулы (26) проведена оценка структурной организации электронных систем всех атомов химических элементов, образующих семь известных периодов периодической системы Д.И. Менделеева. Полученные значения R-функции даны в приводимой периодической таблице и иллюстрируются графиками, представленными на рис. 6-9.
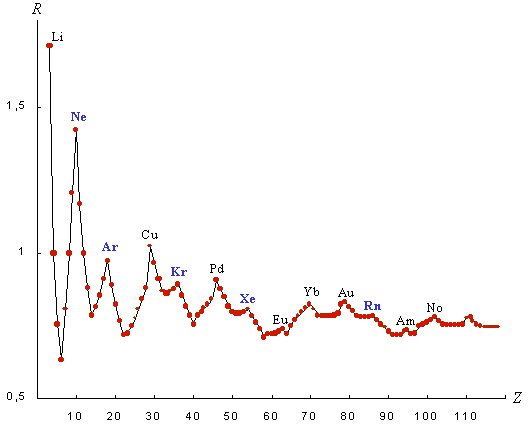
Рис. 6. График R-функции
систем электронных подоболочек
атомов химических элементов
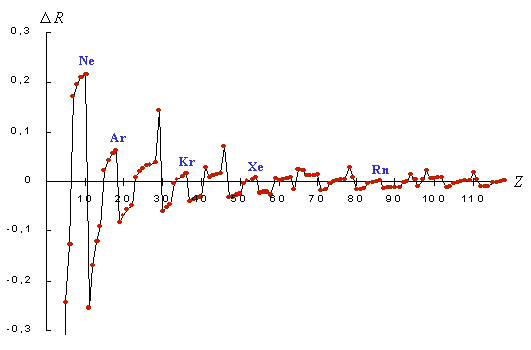
Рис. 7. График приращения R-функции
систем электронных подоболочек
атомов химических элементов
Рис. 8. График R-функции
систем электронных подоболочек
атомов по группам таблицы Д.И.
Менделеева
Рис. 9. График
средних значений R-функции
систем электронных подоболочек
атомов по группам таблицы Д.И.
Менделеева
Анализ этих материалов позволяет высказать следующее. График зависимости значений R-функции от порядкового номера элементов (рис.6) имеет периодический, в целом затухающий характер. В горизонтальном направлении таблицы во всех рядах наблюдается одна и та же закономерность: последовательное понижение значений R-функции в начале ряда и повышение значений по мере приближения к его концу, что коррелируется с общим характером ослабления металлических свойств химических элементов в начале периодов и усилением металлоидных свойств в их конце. Обобщенной наглядной иллюстрацией этого является график средних значений R-функции по группам таблицы Д.И. Менделеева (рис. 9), глубокий минимум которого соответствует четвертой группе. При этом обращает на себя внимание тот факт, что типические элементы четвертой группы – углерод и кремний – занимают главенствующее положение по разнообразию соединений с другими элементами соответственно в живой и неживой природе, причем углерод обладает минимальным значением R-функции среди всех химических элементов.
Особый
интерес представляет график
приращений R-функции ![]() (рис. 7), периодический характер
которого особенно отчетливо
согласуется с периодическим
изменением свойств химических
элементов в горизонтальном
направлении периодической таблицы:
в пределах каждого ряда, на всем его
протяжении, значение
(рис. 7), периодический характер
которого особенно отчетливо
согласуется с периодическим
изменением свойств химических
элементов в горизонтальном
направлении периодической таблицы:
в пределах каждого ряда, на всем его
протяжении, значение ![]() последовательно
увеличивается, а при переходе в
начало следующего ряда резко
падает. В связи с этим можно
предположить, что величина
последовательно
увеличивается, а при переходе в
начало следующего ряда резко
падает. В связи с этим можно
предположить, что величина ![]() является
обобщенной количественной
характеристикой изменения свойств
химических элементов при их
последовательном рассмотрении.
является
обобщенной количественной
характеристикой изменения свойств
химических элементов при их
последовательном рассмотрении.
В пределах вертикальных групп таблицы Д.И. Менделеева также наблюдается устойчивая взаимосвязь изменения значений R-функции и свойств химических элементов, проявляющаяся в частности в том, что усилению металлических свойств в главных подгруппах элементов с увеличением номера больших периодов, соответствует понижение значений R-функции. Анализ графиков по группам таблицы (рис. 8) в свою очередь показывает, что по характеру изменения значений R-функции и согласованности поведения графиков все группы элементов довольно отчетливо делятся на три типа. К первому типу (металлическому) относятся первая, вторая и третья группы, в пределах которых, начиная с третьего ряда и до конца таблицы, происходит последовательное чередование повышенных и пониженных значений R-функции. Элементы четных рядов больших периодов фиксируются при этом пониженными значениями, а элементы нечетных рядов соответственно повышенными. Второй тип (металлоидный) составляют шестая, седьмая и восьмая группы, характеризующиеся двумя последовательными понижениями значений со второго по четвертый и с пятого по одиннадцатый ряды. Третий тип является переходным между первыми двумя и включает в себя четвертую и пятую группы, графики которых обладают чертами как первого, так и второго типа. При этом общий характер графика четвертой группы более соответствует первому типу, а пятой группы – второму.
Таким образом, мы убедились, что изменение свойств химических элементов, как в горизонтальном, так и в вертикальном направлении периодической таблицы Д.И. Менделеева, согласуется с изменением значений R-функции систем электронных подоболочек их атомов. Это позволяет периодическому закону Д.И. Менделеева дать следующую интерпретацию: периодичность изменения свойств химических элементов является отражением периодического изменения значений R-функции систем электронных подоболочек их атомов.