СИСТЕМНЫЕ ОБРАЗОВАНИЯ: ИНФОРМАЦИЯ И ОТРАЖЕНИЕ
Вяткин В.Б.
СТРУКТУРНАЯ
ОРГАНИЗАЦИЯ ЭЛЕКТРОННЫХ СИСТЕМ
АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
В СВЕТЕ СИНЕРГЕТИЧЕСКОЙ ТЕОРИИ
ИНФОРМАЦИИ
// Ergo. Проблемы
методологии междисциплинарных
исследований и комплексного
обеспечения
научно-исследовательской
деятельности. Вып. 4. Екатеринбург:
УрО РАН, 2005
-------------------------------------------------------------------------------------------------------------------------
4. К
вопросу верхней границы
периодичской системы Д.И.
Менделеева
Вопрос о верхней границе периодической системы Д.И. Менделеева является одной из наиболее запутанных и интригующих проблем в учении о периодичности [18]. Конечно, или бесконечно количество химических элементов в природе? [19] А, если конечно, то какой порядковый номер имеет последний элемент? И, является ли этот элемент верхней границей периодической системы, то есть последним членом упорядоченного по свойствам множества химических элементов? Или, быть может, в области больших значений порядковых номеров имеется прерывистый ряд элементов, свойства которых изменяются непериодическим образом и, как следствие, эти элементы находятся за гранью периодической системы Д.И. Менделеева и могут называться внесистемными элементами? Перечень подобных вопросов можно продолжать, но все ответы на них находятся пока в области гипотез. Как отмечали Кедров Б.М. и Трифонов Д.Н. “проблема верхней границы остается не менее загадочной, чем она была, скажем, в конце прошлого столетия (XIX в. – прим. В.В.)” [20].
В настоящем разделе мы попытаемся определить верхнюю границу периодической системы Д.И. Менделеева, для чего проведем специализированный анализ изменения значений R-функции электронных систем атомов химических элементов в плоскости орбитального квантового числа (дополнительно к разд. 2).
Анализ
распределения химических
элементов по орбитальным периодам
структурной организации
электронных систем (11) показывает,
что помимо квадратичной
зависимости (13), между числом
элементов в периоде ![]() и его номером N существует
еще одна связь, математическая
форма которой асимптотически
близка к кубической зависимости:
и его номером N существует
еще одна связь, математическая
форма которой асимптотически
близка к кубической зависимости:
![]() ....................................................................................................(27)
....................................................................................................(27)
При N = 1, 2, 3, 4 формула (27) образует ряд чисел: 2, 16, 36, 68. То есть, в данном случае имеется точное выражение числа элементов для первого второго и третьего орбитальных периодов и приближенное выражение, с относительной погрешностью 6%, для четвертого периода. (В то время, как квадратичная зависимость (13) строго соблюдается во втором, третьем и четвертом периодах, а для первого периода дает завышенное значение с относительной погрешностью 100%.)
Подставляя
значение ![]() из выражения (13) в
выражение (27), получаем уравнение:
из выражения (13) в
выражение (27), получаем уравнение:
![]() . ...................................................................................................(28)
. ...................................................................................................(28)
Анализ
уравнения (28) показывает, что оно
имеет три корня, значения которых
равны 2, 3, 4 (при N = 4 сумма первых двух
членов уравнения округляется до
целого числа). Иначе говоря,
уравнение (28) при ![]() не существует.
Наглядной иллюстрацией этого
является рис. 10, на котором
отчетливо видно, что графики
функций (13) и (27), после четвертого
орбитального периода существенно
расходятся. При этом график
квадратичной функции (13) пересекает
кубическую кривую
не существует.
Наглядной иллюстрацией этого
является рис. 10, на котором
отчетливо видно, что графики
функций (13) и (27), после четвертого
орбитального периода существенно
расходятся. При этом график
квадратичной функции (13) пересекает
кубическую кривую ![]() , а график
квазакубической функции (27)
асимптотически приближается к ней.
То есть, орбитально-волновых
периодов структурной организации
электронных систем, число
элементов в которых удовлетворяет
выражениям (13) и (27), может быть
только три.
, а график
квазакубической функции (27)
асимптотически приближается к ней.
То есть, орбитально-волновых
периодов структурной организации
электронных систем, число
элементов в которых удовлетворяет
выражениям (13) и (27), может быть
только три.
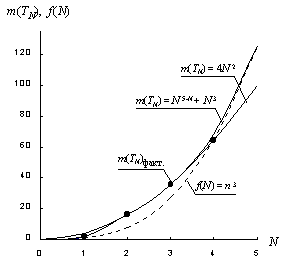
Рис. 10. Зависимость числа элементов в орбитальном периоде от его номера
В отношении
химических периодов ![]() периодической
системы Д.И. Менделеева сказанное
означает, что наблюдаемая
закономерность (21) изменения числа
их элементов
периодической
системы Д.И. Менделеева сказанное
означает, что наблюдаемая
закономерность (21) изменения числа
их элементов ![]() действует только
до седьмого периода включительно,
последний элемент которого имеет
порядковый номер Z = 118.
Соответственно, можно также
утверждать, что известные
закономерности формирования
электронных систем атомов
химических элементов (во всяком
случае, в плоскости орбитального
квантового числа) после 118 элемента
прекращают свое существование.
Короче говоря, уравнение (28)
указывает на то, что 118 химический
элемент может являться последним
элементом периодической системы
Д.И. Менделеева и выступать, таким
образом, в качестве ее верхней
границы. Принимая это за рабочую
гипотезу, проведем дополнительный
(к разд. 2) анализ распределения
электронов в орбитально-волновых
периодах структурной организации и
соотношения последних по числу
элементов, имея своей целью
выявление тех или иных
закономерностей, действие которых
распространялось бы только до 118
элемента. Такой поисковый анализ
позволяет обнаружить и высказать
следующее.
действует только
до седьмого периода включительно,
последний элемент которого имеет
порядковый номер Z = 118.
Соответственно, можно также
утверждать, что известные
закономерности формирования
электронных систем атомов
химических элементов (во всяком
случае, в плоскости орбитального
квантового числа) после 118 элемента
прекращают свое существование.
Короче говоря, уравнение (28)
указывает на то, что 118 химический
элемент может являться последним
элементом периодической системы
Д.И. Менделеева и выступать, таким
образом, в качестве ее верхней
границы. Принимая это за рабочую
гипотезу, проведем дополнительный
(к разд. 2) анализ распределения
электронов в орбитально-волновых
периодах структурной организации и
соотношения последних по числу
элементов, имея своей целью
выявление тех или иных
закономерностей, действие которых
распространялось бы только до 118
элемента. Такой поисковый анализ
позволяет обнаружить и высказать
следующее.
1. Из распределения элементов по орбитальным периодам структурной организации электронных систем (11) следует, что число элементов в каждом последующем орбитальном периоде превосходит общее число элементов, образующих предыдущие периоды:
![]() ........
........![]()
То есть, имеется закономерность:
![]() .
.....................................................................................................(29)
.
.....................................................................................................(29)
Вместе с тем,
если допустить существование
пятого орбитального периода,
охватывающего гипотетические
восьмой и девятый химические
периоды системы Д.И. Менделеева, то
согласно квадратичной зависимости
(13) будем иметь, что ![]() . Но это число
элементов явно меньше, чем
. Но это число
элементов явно меньше, чем ![]() и,
следовательно, можно утверждать,
что закономерность (29) при
и,
следовательно, можно утверждать,
что закономерность (29) при ![]() исчезает. Если же определить число
элементов пятого периода с помощью
квазикубической зависимости (27), то
получим значение
исчезает. Если же определить число
элементов пятого периода с помощью
квазикубической зависимости (27), то
получим значение ![]() , которое
формально удовлетворяет выражению
(29) поскольку 126 > 118. Но, в этом
случае, будет нарушен орбитальный
принцип запрета, который
ограничивает число электронов,
образующих орбитальный период,
квадратичной зависимостью (22),
дающей для пятого орбитального
периода значение 100.
, которое
формально удовлетворяет выражению
(29) поскольку 126 > 118. Но, в этом
случае, будет нарушен орбитальный
принцип запрета, который
ограничивает число электронов,
образующих орбитальный период,
квадратичной зависимостью (22),
дающей для пятого орбитального
периода значение 100.
Закономерность
(29) с позиций электронных
конфигураций атомов объясняется
тем, что при ![]() разнообразие
электронов, образующих данный
орбитальный период, превышает
суммарное разнообразие электронов,
образующих предыдущие периоды (с
учетом номера последних). При
разнообразие
электронов, образующих данный
орбитальный период, превышает
суммарное разнообразие электронов,
образующих предыдущие периоды (с
учетом номера последних). При ![]() такого превышения не происходит,
так как гипотетические g электроны
такого превышения не происходит,
так как гипотетические g электроны ![]() , в
количестве
, в
количестве ![]() , не могут его
обеспечить. Данную интерпретацию
закономерности (29) и ее нарушения
при
, не могут его
обеспечить. Данную интерпретацию
закономерности (29) и ее нарушения
при ![]() наглядно можно
проиллюстрировать следующей
схемой. Возьмем пять
концентрических кругов с радиусами
наглядно можно
проиллюстрировать следующей
схемой. Возьмем пять
концентрических кругов с радиусами
![]() (рис. 11), такими, что
площадь каждого круга превосходит
сумму площадей всех кругов с
меньшим радиусом.
(рис. 11), такими, что
площадь каждого круга превосходит
сумму площадей всех кругов с
меньшим радиусом.
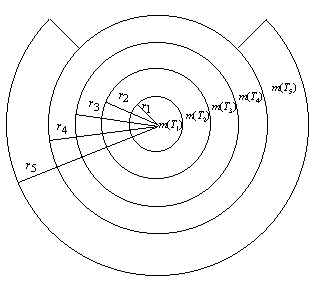
Рис. 11.
Пояснительная схема к
закономерности (29) и ее нарушению
при N = 5
Если теперь
этим кругам, в порядке возрастания
их радиусов, поставить в
соответствие разнообразие
электронов, образующих орбитальные
периоды c ![]() , то в пятом круге
окажется удаленной часть кольца с
внутренним и внешним радиусами
, то в пятом круге
окажется удаленной часть кольца с
внутренним и внешним радиусами ![]() и
и ![]() ,
площадь которой пропорциональна
разности
,
площадь которой пропорциональна
разности ![]() .
.
2.
Эмпирически установлено, что
химическими элементами, в
электронных системах атомов
которых впервые появляются
электроны с новым значением
орбитального квантового числа,
являются водород (s электроны, ![]() ),
бор (р электроны,
),
бор (р электроны, ![]() ), скандий (d электроны,
), скандий (d электроны, ![]() ) и
церий (f электроны,
) и
церий (f электроны, ![]() ). Их порядковые
номера
). Их порядковые
номера ![]() образуют,
соответственно, ряд чисел:
образуют,
соответственно, ряд чисел:
![]() .
...........................................................................................................(30)
.
...........................................................................................................(30)
Сравнение
этого ряда с границами орбитальных
периодов ![]() показывает, что во
втором и третьем периодах новые
электроны (p и d)
появляются
у третьего элемента периода, а в
четвертом периоде (f) – у четвертого
элемента. Это свидетельствует о
том, что между значениями
показывает, что во
втором и третьем периодах новые
электроны (p и d)
появляются
у третьего элемента периода, а в
четвертом периоде (f) – у четвертого
элемента. Это свидетельствует о
том, что между значениями ![]() при
при ![]() и
номерами орбитальных периодов N
существует закономерная
взаимосвязь, которая, учитывая
весьма незначительное отклонение
и
номерами орбитальных периодов N
существует закономерная
взаимосвязь, которая, учитывая
весьма незначительное отклонение ![]() от
от ![]() ,
может быть представлена в
следующем виде:
,
может быть представлена в
следующем виде:
![]() .
....................................................................................................(31)
.
....................................................................................................(31)
По поводу
замены ![]() на
на ![]() следует сказать,
что такая замена при
количественном анализе
периодичности электронных
конфигураций применяется довольно
часто [21]. Дело в том, что
следует сказать,
что такая замена при
количественном анализе
периодичности электронных
конфигураций применяется довольно
часто [21]. Дело в том, что ![]() и
и ![]() являются эмпирическим и
теоретическим значениями
являются эмпирическим и
теоретическим значениями ![]() ,
соответственно. В последнем случае
принимается, что первый f электрон
появляется у лантана и имеет место
так называемая (по А. Зоммерфельду)
идеальная система заполнения
электронных оболочек, в которой не
учитываются нюансы энергетической
стабильности электронных
состояний и “электроны образуют
оболочки и подгруппы в правильной
последовательности”
[22]. В атоме
лантана, вместо теоретически
предсказываемого появления
,
соответственно. В последнем случае
принимается, что первый f электрон
появляется у лантана и имеет место
так называемая (по А. Зоммерфельду)
идеальная система заполнения
электронных оболочек, в которой не
учитываются нюансы энергетической
стабильности электронных
состояний и “электроны образуют
оболочки и подгруппы в правильной
последовательности”
[22]. В атоме
лантана, вместо теоретически
предсказываемого появления ![]() электрона, фактически наблюдается
электрона, фактически наблюдается ![]() электрон.
В энергетическом отношении
электрон.
В энергетическом отношении ![]() и
границы соответствующих
электронных подоболочек
практически неразличимы [23].
Поэтому в дальнейших наших
построениях, имеющих теоретический
характер, будем считать, что
и
границы соответствующих
электронных подоболочек
практически неразличимы [23].
Поэтому в дальнейших наших
построениях, имеющих теоретический
характер, будем считать, что ![]() и,
соответственно, использовать
выражение (31).
и,
соответственно, использовать
выражение (31).
Так как число
элементов в орбитально-волновом
периоде ![]() может быть выражено
через его номер N двумя способами,
то выражение (31) также имеет две
реализации вида
может быть выражено
через его номер N двумя способами,
то выражение (31) также имеет две
реализации вида ![]() . Квадратичная
зависимость (13) для первого
орбитального периода дает
завышение значения
. Квадратичная
зависимость (13) для первого
орбитального периода дает
завышение значения ![]() на 2 элемента,
которое при непосредственном
использовании выражения (31)
автоматически распространяется на
все значения
на 2 элемента,
которое при непосредственном
использовании выражения (31)
автоматически распространяется на
все значения ![]() . Поэтому в данном
случае имеем:
. Поэтому в данном
случае имеем:
![]() . [24]
...........................................................................(32)
. [24]
...........................................................................(32)
Используя, в свою очередь, квазикубическую зависимость (27), получаем:
![]() .
...................................................................(33)
.
...................................................................(33)
Для
различных типов электронов
выражения (32) и (33) дают следующие
значения ![]() [25]:
[25]:
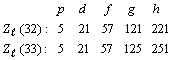 ........................................................................................(34)
........................................................................................(34)
Выражение (34)
показывает, что формулы (32) и (33) дают
одинаковые значения ![]() для p,
d, f электронов,
практически полностью совпадающие
с соответствующими значениями
фактического ряда (30). В случае g
электронов наблюдается различие в
значениях
для p,
d, f электронов,
практически полностью совпадающие
с соответствующими значениями
фактического ряда (30). В случае g
электронов наблюдается различие в
значениях ![]() , которое резко
увеличивается при переходе к h
электронам и находится в согласии с
расхождением при
, которое резко
увеличивается при переходе к h
электронам и находится в согласии с
расхождением при ![]() квадратичной и
квазикубической кривых на рис. 10.
квадратичной и
квазикубической кривых на рис. 10.
Так как
существование электронов с ![]() находится в области гипотез, то
необходимо несколько слов сказать
о существующих представлениях
относительно значения
находится в области гипотез, то
необходимо несколько слов сказать
о существующих представлениях
относительно значения ![]() . Одни
исследователи (В.И. Гольданский [26],
В.М. Клечковский [27] и др.) считают, что
. Одни
исследователи (В.И. Гольданский [26],
В.М. Клечковский [27] и др.) считают, что
![]() и, соответственно,
имеется согласие с квадратичной
зависимостью (32)
и, соответственно,
имеется согласие с квадратичной
зависимостью (32) ![]() от N. Близкое мнение
высказывал также Г. Сиборг [28],
полагая, что наиболее вероятным
является
от N. Близкое мнение
высказывал также Г. Сиборг [28],
полагая, что наиболее вероятным
является ![]() . Другие исследователи
(А. Ларсон, Дж. Вебер, Дж. Манн и др. [29])
приходят к выводу, что
. Другие исследователи
(А. Ларсон, Дж. Вебер, Дж. Манн и др. [29])
приходят к выводу, что ![]() . Последнее
согласуется с квазикубической
зависимостью (33). Наконец, есть
ученые (Г.Н. Флеров, И. Звара), по
мнению которых, “начиная с
экарадия (элемента 118 – прим. В.В.)
любой из первых элементов восьмого
периода может рассматриваться как
потенциальный родоначальник
семейства 5g- или 6f-элементов” [30].
. Последнее
согласуется с квазикубической
зависимостью (33). Наконец, есть
ученые (Г.Н. Флеров, И. Звара), по
мнению которых, “начиная с
экарадия (элемента 118 – прим. В.В.)
любой из первых элементов восьмого
периода может рассматриваться как
потенциальный родоначальник
семейства 5g- или 6f-элементов” [30].
Таким
образом, изложенное в настоящем
пункте свидетельствует о том, что
однозначная закономерность (31)
появления электронов с новым
значением орбитального квантового
числа, имеющая место во втором,
третьем и четвертом орбитальных
периодах, в гипотетическом пятом
периоде сменяется
неопределенностью. Это ставит под
вопрос сам факт существования в
природе электронов с ![]() и, как следствие,
– орбитальных периодов
структурной организации
электронных систем атомов с
порядковым номером
и, как следствие,
– орбитальных периодов
структурной организации
электронных систем атомов с
порядковым номером ![]() .
.
3. Снова
обратимся к графику R-функции на рис. 5.
Как отмечалось в разд. 2, в начале
всех орбитально-волновых периодов
наблюдается последовательное
понижение значений R-функции,
заканчивающееся “региональными”
минимумами у элементов с ![]() . Сопоставление
этих порядковых номеров с
границами периодов
. Сопоставление
этих порядковых номеров с
границами периодов ![]() дает, что
количество элементов в нисходящих
частях
дает, что
количество элементов в нисходящих
частях ![]() орбитальных периодов
при
орбитальных периодов
при ![]() равно 4, 9, 16,
соответственно. Отсюда следует, что
между числом элементов в
нисходящей части
орбитально-волнового периода и его
номером существует закономерная
взаимосвязь:
равно 4, 9, 16,
соответственно. Отсюда следует, что
между числом элементов в
нисходящей части
орбитально-волнового периода и его
номером существует закономерная
взаимосвязь:
![]() .
..........................................................................................................(35)
.
..........................................................................................................(35)
При этом
данные табл. 1 показывают, что в
формировании электронных систем
атомов химических элементов,
расположенных в нисходящих частях
орбитально-волновых периодов,
также присутствует определенная
закономерность. Эта закономерность
(с учетом вышеуказанной замены ![]() на
на ![]() )
заключается в том, что электронные
системы элементов, образующих
нисходящие части периодов, начиная
с третьего элемента, наполняются
исключительно электронами с новым
значением орбитального квантового
числа. То есть конфигурации
электронов, образующих нисходящие
части орбитально-волновых периодов
структурной организации
электронных систем, выглядят
следующим образом:
)
заключается в том, что электронные
системы элементов, образующих
нисходящие части периодов, начиная
с третьего элемента, наполняются
исключительно электронами с новым
значением орбитального квантового
числа. То есть конфигурации
электронов, образующих нисходящие
части орбитально-волновых периодов
структурной организации
электронных систем, выглядят
следующим образом:
![]() .
................................................................(36)
.
................................................................(36)
Если теперь
допустить существование еще одного
орбитально-волнового периода ![]() с
такой же структурой, что и у
предыдущих периодов
с
такой же структурой, что и у
предыдущих периодов ![]() , то окажется, что
гипотетических g электронов
недостаточно для того, чтобы
сформировать нисходящую часть
периода с числом элементов,
удовлетворяющим выражению (35).
Иначе говоря, в силу того, что
, то окажется, что
гипотетических g электронов
недостаточно для того, чтобы
сформировать нисходящую часть
периода с числом элементов,
удовлетворяющим выражению (35).
Иначе говоря, в силу того, что ![]() ,
закономерность (36) при
,
закономерность (36) при ![]() будет нарушена.
будет нарушена.
4. Анализ закономерности (36) показывает, что в ней присутствует довольно интересный и тоже закономерный факт. Дело в том, что каждый раз число электронов с новым значением орбитального квантового числа, образующих нисходящую часть орбитального периода, по отношению к их максимально возможному числу (19) в пределах полупериода (химического периода системы Д.И. Менделеева), увеличивается на одну треть. То есть:
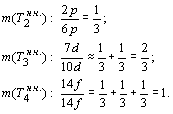 ........................................................................................(37)
........................................................................................(37)
Интерпретация
выражения (37) позволяет говорить о
том, что потенциал числа электронов
для образования подгрупп с новым
значением орбитального квантового
числа при ![]() становится
исчерпанным и, соответственно
новые орбитальные периоды (
становится
исчерпанным и, соответственно
новые орбитальные периоды (![]() )
структурной организации
электронных систем, а также новые
химические периоды
)
структурной организации
электронных систем, а также новые
химические периоды ![]() системы Д.И.
Менделеева не могут быть
образованы.
системы Д.И.
Менделеева не могут быть
образованы.
Таким образом, содержание пунктов 1-4 подтверждает принятую ранее нами гипотезу о 118 химическом элементе как о верхней границе периодической системы Д.И. Менделеева. Поэтому, мы берем на себя смелость утверждать, что с позиций структурной организации электронных систем атомов химических элементов в плоскости орбитального квантового числа, последним элементом периодической системы Д.И. Менделеева является элемент с порядковым номером 118, который замыкает седьмой химический период.
Следует отметить, что сделанный вывод о 118 химическом элементе, как последнем в периодической системе Д.И. Менделеева, находится в определенном противоречии с гипотезой об “островах ядерной стабильности” [31], которая в настоящее время является господствующей во взглядах на существование гипотетических сверхтяжелых элементов. Данная гипотеза основывается на том, что ядра, обладающие “магическим” числом протонов или нейтронов (2, 8, 20, 50, 82, 126) [32], обладают повышенной устойчивостью. Соответственно, допускается возможность существования химических элементов при Z > 118. При этом в отношении периодической системы Д.И. Менделеева утрированно даже принимается, что “теоретически у периодической системы нет ни начала, ни конца” [33]. Вместе с тем, время жизни ядер вне “островов стабильности” может оказаться меньше времени, необходимого для формирования электронных систем и, соответственно, существование химических элементов при Z > 118 будет иметь спорадический характер. Поэтому, выражаясь словами Д.Н. Трифонова, “позволительно спросить: причем же здесь периодическая система с тем ее содержанием, которое вкладывал в нее еще Менделеев!?” [34]. Отвечая на этот вопрос, по-видимому, можно сказать, что если допустить существование элементов с Z > 118, то их следует считать внесистемными, то есть не подчиняющимися закономерностям периодической системы Д.И. Менделеева. Так это, или нет, – покажет время. Учитывая, что сейчас ведутся работы уже по синтезу 118 элемента, то ждать экспериментального уточнения ответа на вопрос о верхней границе периодической системы Д.И. Менделеева придется, по-видимому, относительно недолго.
Литература и примечания к разд. 4
18. Историю вопроса см., например, в работе: Кедров Б.М., Трифонов Д.Н. О современных проблемах периодической системы. М., 1974.
19. В данном случае мы имеем в виду не только Землю, но и Вселенную в целом.
20. Кедров Б.М., Трифонов Д.Н. Указ. соч. С. 17.
21. См., например: Трифонов Д.Н. Указ. соч.
22. Зоммерфельд А. Указ. соч. С. 141.
23. Подобные явления Б.М. Кедров и Д.Н. Трифонов назвали размыванием периодичности (Кедров Б.М., Трифонов Д.Н. Указ. соч.)
24.
Математически подобное выражение
для ![]() ранее было получено
Д.Н. Трифоновым на основе теории
чисел (см. Трифонов Д.Н. Указ. соч.).
ранее было получено
Д.Н. Трифоновым на основе теории
чисел (см. Трифонов Д.Н. Указ. соч.).
25. Задача формализованного определения порядковых номеров элементов, в атомах которых впервые появляются электроны с данным значением орбитального квантового числа, в учении о периодичности является традиционной и имеет широкий спектр решений, в той или иной мере соответствующих фактическому распределению электронов в атомах. При этом, в большинстве случаев, решение осуществляется либо на основе статистической модели атома (Ферми, А. Зоммерфельд, Д. Иваненко, С. Ларин и др.), либо формально-математическим образом, включая подбор уравнений, описывающих ряд известных значений Z (Трифонов Д.Н., Клечковский В.М. и др.) (См., например: Зоммерфельд А. Указ. соч.; Иваненко Д., Ларин С. К теории периодической системы элементов // ДАН СССР. 1953. Т. LXXXVIII, № 1; Трифонов Д.Н. Указ. соч.; Клечковский В.М. Указ. соч.)
26. Гольданский В.И. Периодическая система и проблемы ядерной химии. В сб.: Сто лет периодического закона химических элементов. М., 1969.
27. Клечковский В.М. Указ. соч.
28. Сиборг Г. Эволюция периодической системы элементов со времен Д.И. Менделеева до наших дней. В сб.: Сто лет периодического закона химических элементов. М., 1969.
29. По Сиборгу Г. (указ. соч.) и Трифонову Д.Н. (указ.соч.).
30. Флеров Г.Н., Звара И. Периодическая система и синтез новых элементов. В сб.: Сто лет периодического закона химических элементов. М., 1969. С. 124.
31. Истоки гипотезы восходят к идеям Р. Свинна 1914-1915 г.г., полагавшем, что в определенных промежутках больших значений Z может происходить увеличение времени жизни нестабильных элементов (по Кедрову Б.М., Трифонову Д.Н. Указ. соч.). Популярно о гипотезе см., например: Щеголев В.А. За краем таблицы Менделеева // Природа. 2003, № 1; Оганесян Ю.И. В поисках “островов стабильности” (материал А. Ваганова) // Что нового в науке и технике. 2003, № 1 и др.
32. По работе: Немец О.Ф., Гофман Ю.В. Справочник по ядерной физике. Киев, 1975.
33. Глинка Н.А. Общая химия. (Изд. тридцатое. Под ред. А.И. Ермакова.) М., 2003. С. 89.
34. Трифонов Д.Н. Указ. соч. С. 141.